Çalışmada grafen oksit (GO), Azot katkılanmış grafen oksit (NGN-OKSİT) ve azot katkılanmış grafen (NGN) ile MCF-7 (ATCC® HTB-22™ , östrojen reseptör pozitif insan meme kanseri), A549 (ATCC® CCL-185, insan akciğer epitelyal karsinoma) ve 293-T (ATTC CRL-1573, insan embriyonik böbrek epitel) hücre hatları kullanılmıştır.A549 akciğer karsinom hücrelerinin canlılığı üzerine en fazla etkiyi NGN göstermiştir. 24 saatlik inkübasyon süresi sonunda NGN için IC50 değeri 195 μg/ml olarak saptandı.
Aynı hücreler de NGN-OKSİT için belirlenen IC50 değeri 833 μg/ml’dir. Grafen oksit A549 hücrelerinde 1000 μg/ml’lik en yüksek dozda sadece % 17 oranında ölüme yol açmıştır.
MCF-7 meme kanseri hücrelerinin canlılığı üzerine en fazla etkiyi NGN göstermiştir. 24 saatlik inkübasyon süresi sonunda NGN için IC50 değeri 377 μg/ml olarak saptanmıştır. Aynı hücreler de NGN-OKSİT ve grafenoksit en fazla etkiyi test edilen en düşük doz olan1.9 μg/ml’lik dozda göstermiş ve sırasıyla % 18 ve % 11 oranında ölüme yol açmıştır.
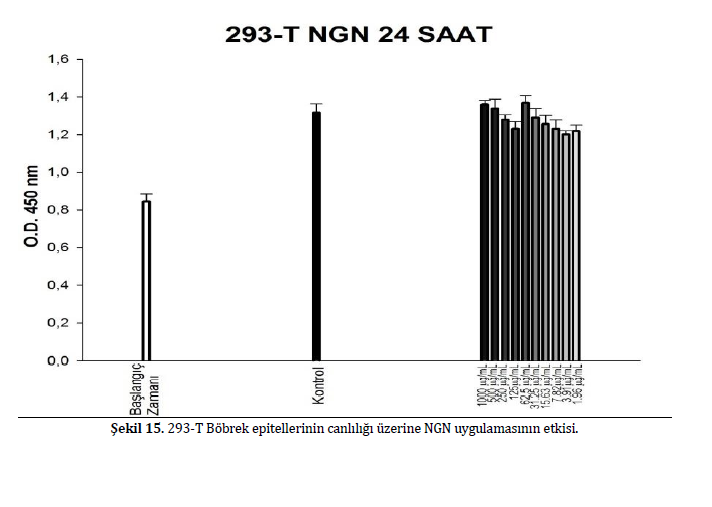
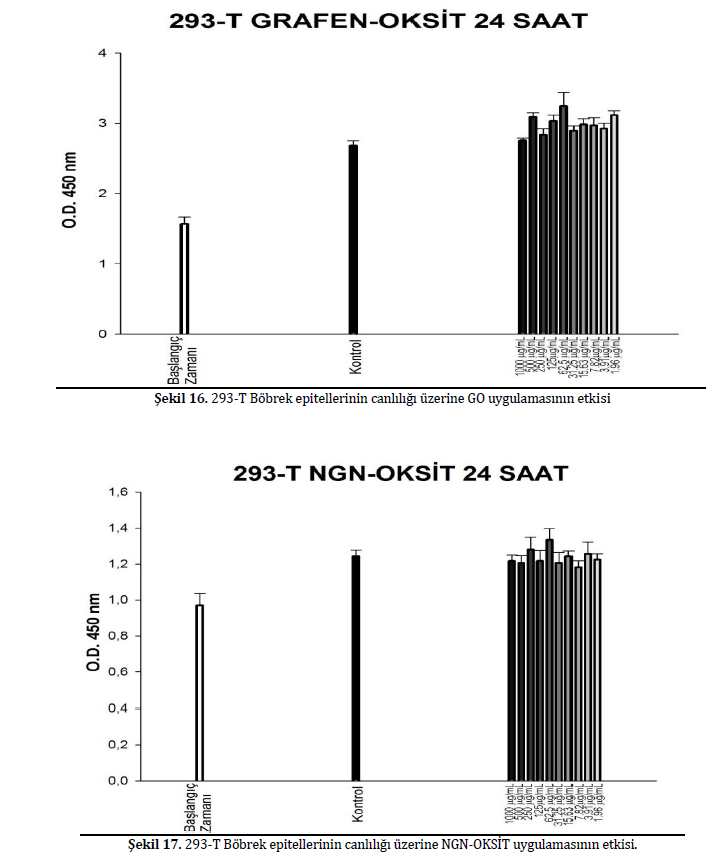
Test edilen hiçbir grafen türevi epitel hücreleri üzerinde istatistiksel olarak önemli olduğu saptanan sitotoksik bir etki göstermemiştir.
GİRİŞ
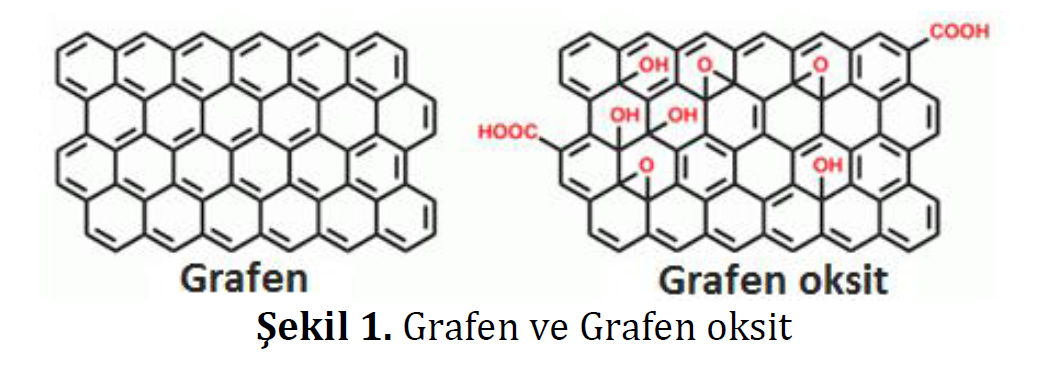
Grafit, yumuşak, yağlı, kâğıt üzerinde iz bırakan, siyah renkli katı bir maddedir. Grafit kristal yapılı olup grafen tabakalarından oluşur. Grafen, karbon atomunun bal peteği örgülü yapılarından bir tanesine verilen isimdir. Periyodik tablodaki en ilginç elementlerden biri Karbon atomudur. Karbonun, grafit (kurşun kalem, katı yağlayıcılar vb.) ve elmas gibi gündelik hayattan çok iyi bilinen allotroplarının yanında nanotüp ve fulleren gibi yeni sentezlenen formları da mevcuttur. Özellikle karbon nanotüpler ve C60 (fulleren) molekülleri ilk sentezlendikleri yıllardan günümüze kadar katı hal fiziğini son derece aktif araştırma alanları arasına girmiştir. Bal peteği kristal yapısında, sp2 melezleşmesi yapan; grafitin, nanotübün ve C60'ın ana yapıtaşı olan grafen ise ancak 2004 yılında sentezlenebilmiştir (Şekil 1). İngilizce'de "Graphite" ve "ene" kelimelerinden türetilen "graphene" terimi türkçede grafen olarak karşılık bulmuştur. 2010 Nobel Fizik Ödülü, "iki-boyutlu grafen malzemesine ilişkin çığır açan deneyleri için" Andre Geim ve Konstantin Novoselov'a verilmiştir [1].
Grafen, 1 atom kalınlığında, sp2 hibrit carbon atomlarının bağlanmasıyla oluşmuş düzlemsel karbon malzeme olarak tanımlanmaktadır [2]. Grafen kristalinde her bir karbon atomu, sahip olduğu π elektronları ile delokalize elektron ağının oluşmasına katkıda bulunur. Grafenin, ilk olarak 2004 yılında Novoselov ve arkadaşları tarafından "sticky bant" kullanılarak mikromekanik ayırma yöntemiyle grafitten izole edilmesinden sonra, grafen konusunda yapılan çalışmalar çok hızlı bir şekilde artmıştır [2]. Grafenin düzlemsel delokalize elektron ağı, elektronların yapı içerisinde relativistik hızlarda hareketine izin verir. Grafen, bu yapısı nedeniyle çok yüksek elektriksel ve termal iletkenliğe, yüksek optik geçirgenliğe, yüksek mekaniksel dayanım ve esnekliğe ve çok yüksek teorik spesifik yüzey alana (2630 m2/g) sahiptir. Ayrıca, yüksek kimyasal dayanım ve toksik olmama gibi özellikleri de bildirilmiştir [3]. Bu sıra dışı özelliklerin bir veya birkaçının bir arada bulunması, grafeni mevcut teknolojilerin yerini alabilecek yeni süper özellikli teknolojilerde kullanılacak malzeme haline getirmiştir. Örneğin, optik geçirgenlik, esneklik ve iletkenlik özellikleri birleştirilerek esnek elektroniklerin üretiminde kullanılabilir. Bunun yanında grafenin, alan etkili transistörler, dokunmatik ekranlar, enerji depolama ve dönüşümü (Lityum-iyon piller ve yakıt hücreleri, elektrokimyasal süper kapasitörler, boya duyarlı güneş pilleri) ve sağlık alanında (Hücre görüntüleme, fotokemoterapi, ilaç salınımı, biyosensörler ) gibi birçok alanda kullanılma potansiyeli vardır [3].
Kelime anlamı olarak kanser, bir organ veya dokudaki hücrelerin düzensiz olarak bölünüp çoğalmasıyla beliren kötü urlara denir. Genel anlamda ise kanser vücudumuzun çeşitli bölgelerindeki hücrelerin kontrolsüz çoğalması ile oluşan 100'den fazla hastalık grubudur. Çok çeşitli kanser tipleri olmasına rağmen, hepsi anormal hücrelerin kontrol dışı çoğalması ile başlar. Tedavi edilmez ise ciddi rahatsızlıklara, hatta ölüme dahi neden olabilir. Kanser (cancer) terimi, tıbbın babası olarak bilinen Yunan fizikçi Hippocrates (MÖ 460-370) tarafından oluşturulmuştur. Hippocrates carcinos ve carcinoma terimlerini ülser oluşturan ve ülser oluşturmayan tümörler için kullanmıştır. Kadınlarda en çok meme, rahim ve kalın bağırsak kanseri; erkeklerde ise en çok akciğer, prostat, mide ve kalın bağırsak kanserleri görülmektedir. Tüm kanserlerin %16'sı, tüm kanser ölümlerinin %28'i erkeklerde %35, kadınlarda %19 akciğer kanseri nedeniyledir. Akciğer kanseri büyük ölçüde sigara kullanımı ile ilişkilidir [4]. Özetle, kanser modern tıbbın en büyük sorunlarından biridir. 2012 yılında dünya üzerinde 14 milyon yeni kanser vakası kaydedildi. Dünya Sağlık Örgütü (DSÖ) her yıl kanser vakası sayısının artacağını; 2025 yılında kanser vaka sayısının 19 milyona, 2030'da 22 milyona ve 2035'te ise 24 milyona ulaşabileceğini bildirmektedir. Ve dahası DSÖ'ye göre, kanseri önlemek için gösterilen çaba ne yazık ki yeterli değildir. Kanseri tedavi edecek yeni ajanlar, yöntemler üzerinde çalışılmalıdır. Bu bağlamda, farklı birçok nanopartikül kanser tedavisinde kullanım için test edilmektedir ve son yıllarda grafen ve grafen bazlı nanomalzemeler kimyasal, fiziksel ve mekanik özellikleri nedeniyle kanser tedavisinde ilgi çekmektedir. Grafen bazlı nanomalzemeler antikanser ajanlar olarak fototermal terapide, ilaç taşıyıcı olarak ve dahası tek başlarına nano ilaçlar olarak uygulanabilmektedir [5]. Literatürlerde grafen oksit (GO)’in kanser çalışmalarında kullanıldığı çalışmalar mevcuttur [5, 6]. Diğer taraftan, azot katkılanmış grafen oksit (NGN-OKSİT) ve azot katkılanmış grafen (NGN) ile ilgili hiçbir çalışmaya rastlanılmamıştır. Bu çalışmada özellikle sentezlediğimiz özgün grafen türevlerinin (NGN-OKSİT ve NGN), en sık görülen iki kanser tipi olan akciğer ve meme kanserlerindeki sitotoksik etkilerini tespit ederek antikanser potansiyelleri olup olmadığını belirlemek amaçlanmıştır.
2. Materyal ve Metot
2.1. Grafen Oksit (GO), Azot Katkılanmış Grafen Oksit (NGN-OKSİT), Azot Katkılanmış Grafen (NGN) ve Hücre Hatları
Materyal olarak çalışmada XG Sciences firmasından temin edilen xGnP-M-5 kodlu grafen oksit (GO) ve solvotermal yöntemle sentezlenen azot katkılanmış grafen oksit (NGN-OKSİT) ve azot katkılanmış grafen (NGN) kullanılmıştır. Hücre hatları olarak MCF-7 (ATCC® HTB-22™ , östrojen reseptör pozitif insan meme kanseri), A549 (ATCC® CCL-185, insan akciğer epitelyal karsinoma) ve 293-T (ATTC CRL-1573, insan embriyonik böbrek epitel) kullanılmıştır.
2.2. Grafen Oksit (GO), Azot Katkılanmış Grafen Oksit (NGN-OKSİT) ve Azot Katkılanmış Grafen (NGN) Üretilme Yöntemi
Azot katkılanmış grafen oksit (NGN-OKSİT) ve azot katkılanmış grafen (NGN) üretilme yöntemi şu şekildedir. Yöntemde indirgeyici olarak da metalik sodyum kullanılmıştır. Buna göre, belirli miktarda N,N-dimetilformamid (DMF) ve metalik Na yüksek basınç reaktörünün teflon haznesine yerleştirilmiş ve ağzı sıkıca kapatılmıştır. Karışım 190 oC'de 72 saat bekletildikten sonra oda sıcaklığına kadar soğuması beklenmiş ve ardından teflon haznesinin ağzı dikkatlice açılarak oluşan ürün HCl çözeltisi ile nötralize edilmiştir. Fazla Na ile HCl arasındaki reaksiyon tamamlandıktan sonra karışım vakumlu sistemde PVdF membranla süzülüp, deiyonize su ile yıkandıktan sonra 90 oC'de kurutulmuştur. Oluşan ürün NGN-OKSİT olarak etiketlenmiştir. NGN-OKSİT’in bir kısmı Ar atmosferinde, 900 oC' de piroliz edilmiş ve böylece azot atomlarının grafen plakalarına kovalent olarak bağlanması sağlanarak NGN elde edilmiştir. GO ve NGN, taramalı elektron mikroskobu (SEM, LEO 1430) X-ışını fotoelektron spektroskopisi (XPS) teknikleri ile karakterize edilmiştir. Örneklerin yüzey alanları N2 adsorpsiyon yöntemi ile belirlenmiştir.
2.3. Hücreler ve Kültür Koşulları
MCF-7 (ATCC®HTB-22™, östrojen reseptör pozitif insan meme kanseri), A549 (ATCC®CCL-185, insan akciğer epitelyal karsinoma) ve 293-T (ATTC CRL-1573, insan embriyonik böbrek epitel) hücre hatlarının her biri % 10 Fetal Bovin Serum, 0.02 mM esansiyel olmayan amino asit karışımı, 1 mM Na-pirüvat, 4 mM L-glutamin ve 80 mg gentamisin ilave edilmiş RPMI-1640 besi yeri kullanılarak 37°C’de %5 CO2’li Memmert marka etüvde kültüre edilmiştir.
2.4. Hücrelere GRAFEN Uygulaması ve Hücre Canlılığının Belirlenmesi
GO, NGN, ve NGN-OKSİT serumsuz besi yeri içerisinde çözdürülerek 1 mg/mL’lik ana stoklar hazırlandı. Hücreler stoktan açılarak küçük petri kaplarına ekildi ve petri kapları %80-90 oranında dolunca tripsinizasyon ile kaldırılıp 1x104 hücre/kuyucuk olacak şekilde 96 kuyucuklu steril plaklara bölündü. 24 saatlik süre ardından besiyerleri uzaklaştırılıp, grafenler en yüksek doz 1000 μg/ml olacak şekilde seri dilüsyon ile yarı yarıya dozlar azaltılarak hazırlanmış %1 serum içeren besiyerlerine eklendi. Grafen uygulamasını takiben tek bir sıra kuyucuktaki hücre canlılığı saptandı (Başlangıç zamanı). 24 saatlik inkübasyon sonrasında hücrelerin canlılığı WST-1 testi ile saptandı. WST-1 testi canlı hücrelerdeki metabolik aktiviteyi, hücrelerin WST-1’i parçalayarak çözülebilir formazan tuzları oluşturması ile ölçmektedir. Bunun için süre sonunda besi yerleri uzaklaştırılarak kuyucuklara 90 μl serumsuz besiyeri ve WST-1 karışımından 10 μl eklenerek 37°C de 2 saat inkübe edildi. İnkübasyon süresi sonunda örneklerin absorbansları, Thermo Scientific Marka ELISA okuyucuda 450 nm dalga boyunda okunarak kaydedildi. Sitotoksisite testlerinden elde edilen deney sonuçlarındaki kontrol ve diğer gruplar arasındaki farklılık GraphPad Instat istatistik programında, Tek Yönlü Anova Testi ve ardından Dunnet Çoklu karşılaştırma Testi kullanılarak değerlendirildi. Hücrelerin canlılığının %50 azalmasını sağlayan dozlar (IC50) belirlenebilmesi için formül (formül 1) kullanılarak her bir doz için ölü hücre yüzdesi hesaplandı. Elde edilen % ölüm değerleri SigmaPlot 10.0 programı kullanılarak grafiklenmiş ve IC50 değerleri saptanmıştır.
3. Bulgular
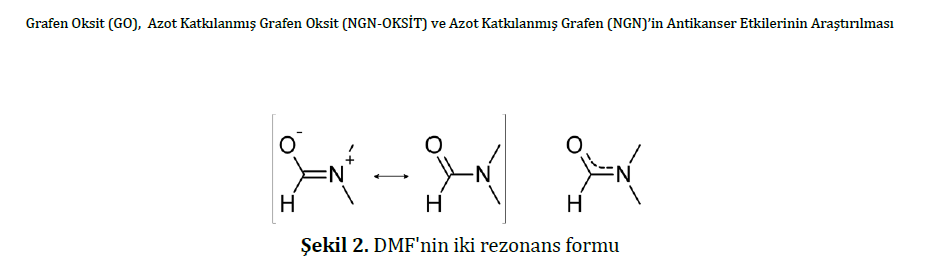
NGN-OKSİT ürünü, NGN üretiminde oluşan yüksek oranda azot ve oksijen içeriğine sahip ara üründür. DMF, Şekil 2’de gösterilen rezonans formları ile solvotermal koşullarda ve indirgen varlığında grafen oluşturabilmektedir.
Solvotermal yöntemle grafen oluşumunda, karbon iskeletinin sodyum varlığında oluşan metil radikalleri üzerinden başladığı, iskelet büyümesinin ise karbonil bağının açılarak metil radikalleri ile eter oluşturması üzerinden ilerlediği bildirilmiştir [7, 8]. Dolayısı ile NGN-OKSİT ara ürününün yüksek molekül ağırlıklı aromatikorganik eter, alkilamin ve amid gibi çeşitli organik bileşiklerden oluşan karışım olduğu düşünülmektedir.
GO ve üretilen NGN nin morfolojik yapısı Taramalı Elektron Mikroskobu (SEM) ile belirlenmiştir. GO ve NGN’ye ait SEM görüntüleri Şekil 3’de verilmiştir.
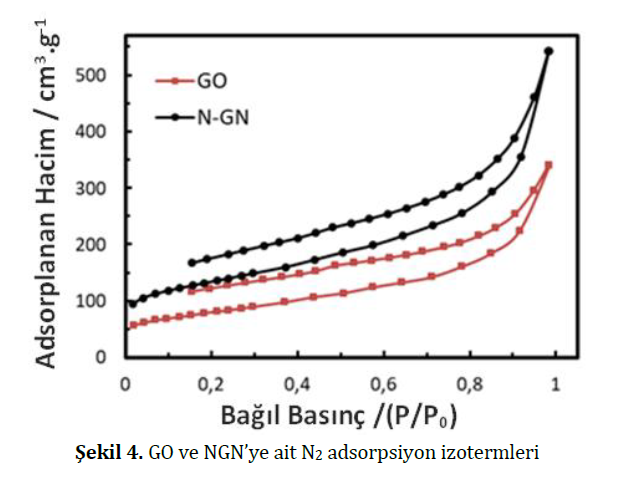
Şekil 3(a)’dan GO nun ortalama 120 nm’den daha büyük partiküllerden oluştuğu görülmektedir. Azot katkılanmış grafenin ise graphene özgü dalgalı ipek yapısında ve daha geniş tabakalı grafen katmanlarından oluştuğu gözlenmektedir (Şekil 3 (b)). Bu durum, piroliz sonucu oluşan amonyak ve alkil aminler gibi gaz ürünlerin yüksek sıcaklıklarda grafen plakalarını birbirinden ayırmasının bir sonucudur [9]. GO ve NGN’ye ait N2 adsorpsiyon izotermleri Şekil 4’de gösterilmiştir;
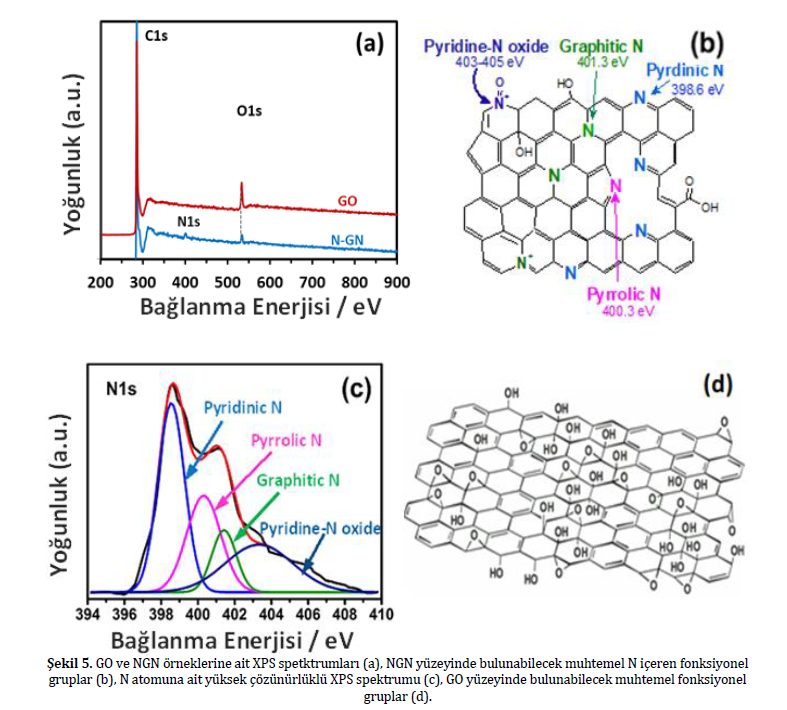
GO ve NGN için N2 adsorpsiyon izoterm verileri kullanılarak hesaplanan spesifik yüzey alan değerleri (SBET) sırasıyla 210 m2/g ve 585 m2/g olarak bulunmuştur. NGN’nin SBET değerinin GO dan yüksek olması, SEM görüntülerinden elde edilen sonuçlar ile uyumlu olarak, termal genişleme yüksek sıcaklık işleminde gaz ürünler oluşturarak plakaların genişlediğini kanıtlamaktadır [7]. Yüksek sıcaklıkta azot içerikli gaz ürünlerin oluşması grafen plakalarındaki kusurlu bölgelere azot atomlarının katkılanabileceğini de akla getirmektedir. Bu öngörü XPS ile test edilebilir. XPS yüzey elementlerinin oranları ve bağlanma şekilleri konularında bilgi veren önemli bir tekniktir. GO ve NGN örneklerine ait XPS spektrumları Şekil 5 (a)’da verilmiştir. GO da yaklaşık 535 eV da gözlenen oksijen atomu miktarının NGN de azaldığı görülmektedir. Diğer taraftan, NGN spektrumunda 398 eV’da N atomuna ait bir pik gözlenmiştir. Bu durum grafenin yapısına N atomlarının katkılandığının kanıtıdır. Ayrıca, 535 eV’da oksijenin de gözlenmesi, yapıdaki N atomlarının bir bölümünün oksit formunda olduğuna işaret etmektedir (Şekil 5(b)).
N atomuna ait 398 eV’daki pikin yüksek çözünürlükte incelenmesi ve bu verilerin simülasyonla işlenmesi sonucu NGN yüzeyindeki N atomlarının pyridnium, pyrrole, graphitic ve pyrdine-N oksit gruplarından oluştuğu belirlenmiştir (Şekil 5c) [10].
NGN, NGN-OKSİT ve GO’nun MCF-7 (ATCC®HTB-22™, östrojen reseptör pozitif insan meme kanseri), A549 (ATCC®CCL-185, insan akciğer epitelyal karsinoma) ve 293-T (ATTC CRL-1573, insan embriyonik böbrek epitel) hücre hatlarına uygulanmasıyla elde edilen sonuçlar aşağıda verilmiştir.
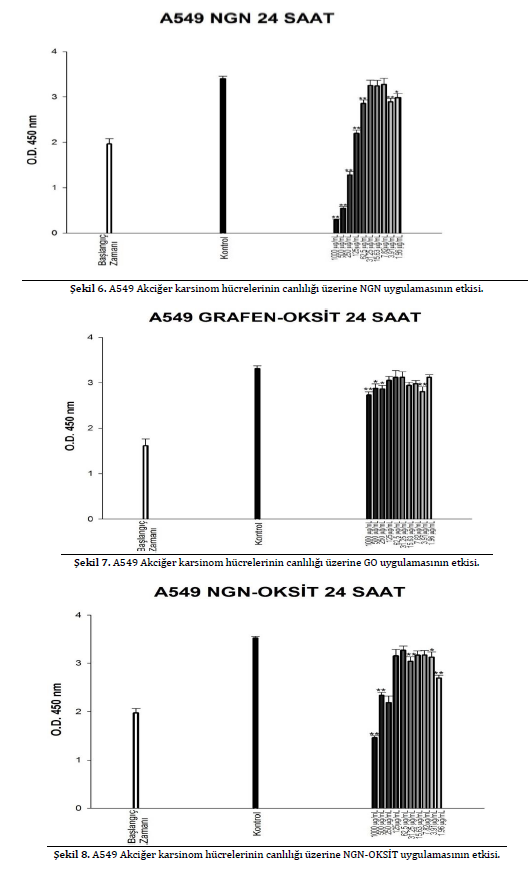
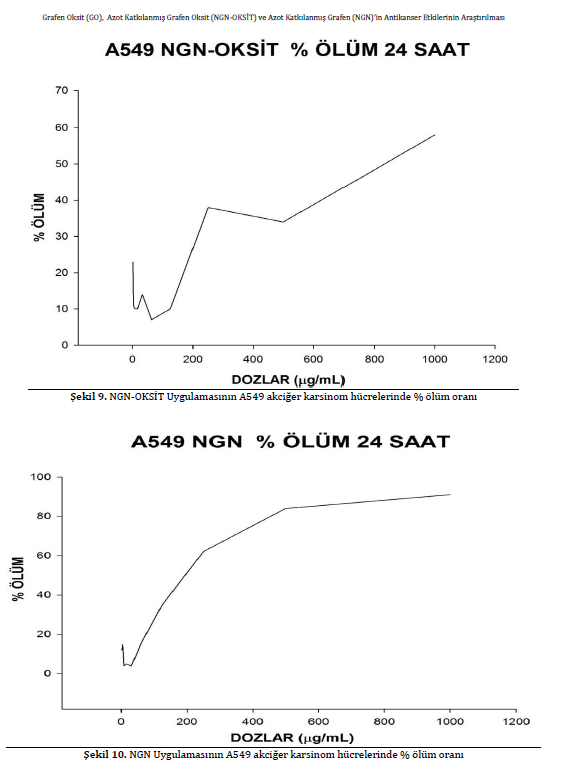
A549 akciğer karsinom hücrelerinin canlılığı üzerine en fazla etkiyi NGN göstermiştir. 24 saatlik inkübasyon süresi sonunda NGN için IC50 değeri 195 μg/ml olarak saptandı. Aynı hücreler de NGN-OKSİT için belirlenen IC50 değeri 833 μg/ml’dir. Grafen oksit A549 hücrelerinde 1000 μg/ml’lik en yüksek dozda sadece % 17 oranında ölüme yol açmıştır. A549 hücreleri için sitotoksisite ve % ölüm durumları Şekil 6, 7, 8, 9 ve 10’da verilmiştir.
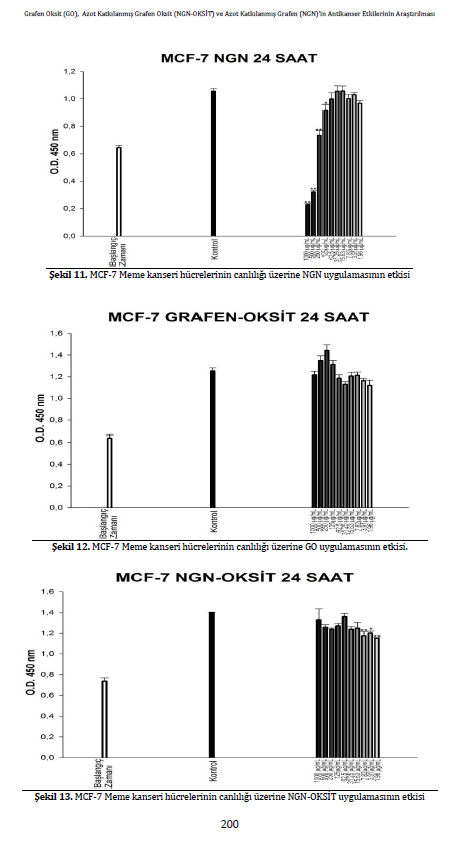
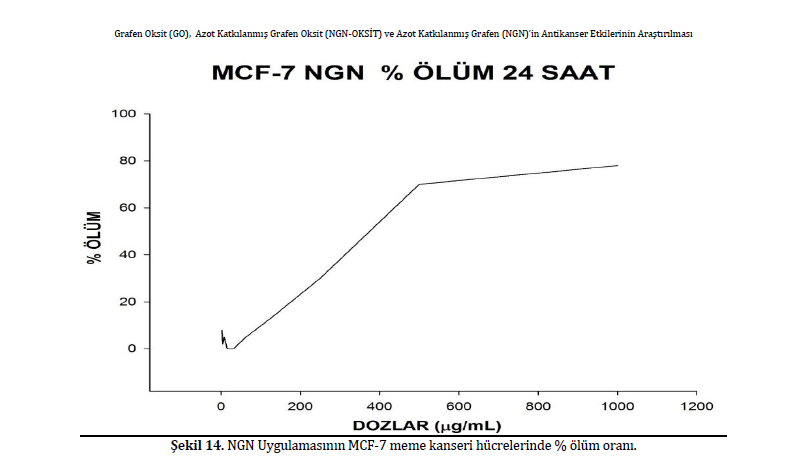
MCF-7 meme kanseri hücrelerinin canlılığı üzerine en fazla etkiyi NGN göstermiştir. 24 saatlik inkübasyon süresi sonunda NGN için IC50 değeri 377 μg/ml olarak saptanmıştır. Aynı hücreler de NGN-OKSİT ve grafenoksit en fazla etkiyi test edilen en düşük doz olan1.9 μg/ml’lik dozda göstermiş ve sırasıyla % 18 ve % 11 oranında ölüme yol açmıştır. MCF-7 hücreleri için sitotoksisite ve % ölüm durumları Şekil 11, 12, 13, ve 14’de verilmiştir.
Kullanılan grafen türevlerinin seçici sitotoksik etki gösterip göstermediğini saptamak için denemelerin hepsi 293-T böbrek epitelleri kullanılarak tekrarlanmıştır. Test edilen hiçbir grafen türevi epitel hücreleri üzerinde istatistiksel olarak önemli olduğu saptanan sitotoksik bir etki göstermemiştir. Bu hücreler için çizilen siotoksisite şekilleri Şekil 15, 16 ve 17’da verilmiştir.
4. Tartışma ve Sonuç
Grafen ve türevleri, elektronik, enerji, malzeme ve biyomedikal alanlardaki potansiyel uygulamaları göz önüne alındığında son yıllarda oldukça dikkat çekmektedir. Ancak, grafen ve türevlerinin toksisiteleri ve biyo uyumlulukları hakkında çok az bilgi mevcuttur.
Çalışmada grafen ve türevlerinin 293-T hücre hattında zamana ve doza bağlı sergilediği sitotoksik etki araştırılmıştır. Elde edilen bulgular grafen ve türevlerinin test edilen hiçbir dozda ve hiç bir inkübasyon süresinde 293T insan böbrek epitellerinde sitotoksik etki göstermediğini ortaya koymaktadır. Var olan kanser tedavilerinin en başında gelen kemoterapinin en önemli yan etkileri, normal epitel hücrelerde de toksik etkiler yaratması sonucu hastalarda saç dökülmesi, kusma ve diare gibi toksik yanıtların oluşmasına yol açmasıdır. Bu bağlamda böbrek epitellerinde hiç bir sitotoksik etki yaratmadığını tesbit edilen grafen ve türevlerinin MCF-7, A549 kanser hücreleri üzerindeki sitotoksik etkileri araştırılmıştır.
Test edilen grafen türevleri arasında A549 akciğer karsinom hücrelerinin canlılığı üzerine en fazla etkiyi NGN göstermiştir. Yirmi dört saatlik inkübasyon süresi sonunda NGN ve NGN-OKSİT için IC50 değerleri sırasıyla 195 μg/ml ve 833 μg/ml olarak saptanmıştır. Grafen oksit ise A549 hücrelerinde istatistiksel açıdan önemli olduğu kabul edilen herhangi bir sitotoksik etki yaratmamıştır. Elde edilen bulgular Chang ve arkadaşlarının yaptığı çalışmanın sonuçları ile paraleldir. Chang ve arkadaşları Grafen oksitin A549 hücresine girmediğini ve belirgin bir sitotoksisiteye sahip olmadığını ancak doza bağımlı bir oksidatif strese neden olabileceğini ve yüksek dozlarda hücre canlılığında azalmaya neden olduğunu bildirmişlerdir. Chang ve arkadaşları çalışmalarında en yüksek doz olarak 200 μg/ml kullanmışlardır [11]. Çalışmada kullanılan 1000 μg/ml’lik en yüksek doz ise sadece % 17 oranında hücre ölüme yol açmıştır.
Çalışmada MCF-7 meme kanseri hücrelerinin canlılığı üzerine en fazla sitotoksik etkiyi yine NGN göstermiştir. 24 saatlik inkübasyon süresi sonunda NGN için IC50 değeri 377 μg/ml olarak saptanmıştır.. Aynı hücrelerde NGN-OKSİT ve Grafenoksit en fazla etkiyi test edilen en düşük doz olan1.9 μg/ml’lik dozda göstermiş ve sırasıyla % 18 ve % 11 oranında ölüme yol açmıştır. 2013 yılında Gurunathan ve arkadaşlarının yaptıkları çalışmada GO ve türevi olan Bor katkılanmış indirgenmiş grafen oksit (B-rGO)'nun 24 saat sonundaki sitotoksik etkilerini bizim de çalışmamızda kullandığımız MCF-7 hücreleri üzerinde araştırmışlardır. Gurunuthan ve arkadaşları 60 μg / mL ‘lik dozda GO ve türevi olan B-rGO’nun MCF-7 hücrelerinde bariz bir sitotoksik etki sergilediğini bildirmişlerdir. [12]. NGN ve NGN-OKSİT’in kanser hücrelerinde gösterdiği yüksek sitotoksik etkinin, NGN ve NGN-OKSİT yüzeyinde bulunan ve Şekil 5a,b’ de gösterilen azot ve azotoksit fonsiyonel gruplarıyla ilişkili olduğu düşünülmektedir. Grafenin hidrofobisitesinin yüksek olması NGN ve NGN-OKSİT’in hücre zarına tutunmasını kolaylaştırarak bu fonsiyonel grupların hücre zarı ile etkileşimini artırmaktadır. Diğer taraftan, ön görülen bu etkilerin NGN ve NGN-OKSİT’e maruz kalmış hücrelerin ileri teknikler ile araştırılması ve desteklenmesini gerektirmektedir.
Elde edilen sonuçlar önemli olup birçok kanser çalışmalarında yol gösterici olacağı düşünülmektedir. Ayrıca bu araştırmadan elde edilen veriler daha sonra yapılacak kanser çalışmalarının başarısına katkı sağlayacaktır.
Kaynakça
[1] https://www.nobelprize.org/prizes/physics/2010/summary/(Erişim Tarihi: 22.11.2018)
[2] Novoselov, K.S., Geim, A.K., Morozov, S.V., Jiang, D., Zhang, Y., Dubonos, S.V., 2004. I.V.Grigorieva, A.A. Firsov, Science 306(2004), 666–669.
[3] Sun, L., Wang, L., Tian, C., Tan, T., Xie, Y., Shi, K., Li, M., Fu, H., 2012. RSC Adv. 2(2012), 4498–4506.
[4] https://hsgm.saglik.gov.tr/tr/kanser-nedir-belirtileri (Erişim Tarihi: 30.11.2018)
[5] Zuchowska, A., Chudy, M., Dybko, A., Brzozka, Z., 2017. Graphene as a new material in anticancer therapy-in vitro studies. Sensors and Actuators B 243(2017). 152–165.
[6] Afarideh B, Rajabibazl M, Omidi M, Yaghmaee B, Rahimpour A, Khodabakhshi R, Sarvarian S, 2018. Anticancer Activity of Graphene Oxide/5-FU on CT26 Ds-Red Adenocarcinoma Cell Line, Oriental Journal of Chemistry, ISSN: 0970-020 X, CODEN: OJCHEG, Vol. 34(2018), No: 4, 2002-2007.
[7] Jeon, I.Y., Shin, Y.R., Sohn, G.J., Choi, H.J., Bae, S.Y., Mahmood, J., Jung, S.M., Seo, J.M., Kim, M.J., Chang, D.W., Dai, L.M., Baek, J.B, 2012. Proc. Natl. Acad. Sci. U.S.A., 109(2012), 5588-5593.
[8] Cui, H., Zheng, J., Yang, P., Zhu, Y., Wang, Z., Zhu, Z., 2015. ACS Appl. Mater. Interfaces, 7(2015), 11230−11238.
[9] Sheng, Z.H., Shao, L., Chen, J.J., Bao, W.J., Wang, F.B., Xia, X.H., 2011. ACS nano 6(2011), 4350–4358.
[10] Bayram, E., Yilmaz, G., Mukerjee, S., 2016. Appl. Catal. B: Environ. 192(2016), 26–34.
[11] Chang, Y., Yang, S-T, Liu, J-H, Dong, E, Wang, Y., Cao, A., Liu, Y., Wang, H., 2011. In vitro toxicity evaluation of graphene oxide on A549 cells. Toxicology Letters 200(2011), 201–210.
[12] Gurunathan, S., Han, J.W., Eppakayala, E., Kim, J-H., 2013. Green synthesis of graphene and its cytotoxiceffects in human breast cancer cells. International Journal of Nanomedicine 8(2013), 1015–1027.